Memahami Konsep Dasar Stoikiometri, Panduan Lengkap untuk Siswa SMA

STOIKIOMETRI merupakan salah satu konsep penting dalam kimia yang mempelajari hubungan kuantitatif antara pereaksi dan produk dalam reaksi kimia.
Dengan memahami stoikiometri, kita dapat menghitung jumlah zat yang dibutuhkan atau dihasilkan dalam suatu reaksi kimia. Istilah ini berasal dari bahasa Yunani, yaitu “stoicheion” yang berarti elemen, dan “metron” yang berarti ukuran.
Konsep ini membantu kita untuk mengukur dan memprediksi hasil reaksi kimia berdasarkan persamaan yang seimbang.
Konsep Dasar Stoikiometri
1. Persamaan Kimia Seimbang
Persamaan kimia menunjukkan bagaimana zat-zat berinteraksi dalam reaksi.
Setiap persamaan harus seimbang, artinya jumlah atom dari masing-masing unsur di sisi pereaksi (kiri) harus sama dengan jumlah atom di sisi produk (kanan).
Hal ini memastikan bahwa tidak ada atom yang hilang atau terbentuk secara ajaib.
Misalnya:
2 jam2+HAI2→2 jam2HAI
Dalam reaksi ini, ada 4 atom hidrogen dan 2 atom oksigen di kedua sisi persamaan. Ini menunjukkan bahwa persamaan tersebut seimbang.
-
Mol dan Massa Mol
Mol adalah satuan untuk menghitung jumlah partikel (atom atau molekul) dalam zat. Satu mol mengandung sekitar 6,022 × 10²³ partikel (bilangan Avogadro). Massa molar adalah massa satu mol dari suatu zat, yang bisa ditemukan di tabel periodik. Misalnya, massa molar hidrogen (H) adalah 1 g/mol, dan oksigen (O) adalah 16 g/mol.
-
Konversi Antara Gram dan Mol
Hubungan antara massa dan mol dinyatakan dengan rumus:

Langkah-langkah Perhitungan Stoikiometri
Untuk melakukan perhitungan stoikiometri, langkah-langkah berikut bisa diikuti:
1. Tuliskan Persamaan Kimia Setara
Mulailah dengan memastikan bahwa persamaan kimia yang diberikan sudah seimbang. Jumlah atom dari setiap unsur harus sama di kedua sisi.
2. Konversi Gram atau Quantity ke Mol
Jika yang diberikan adalah massa, ubah menjadi mol dengan menggunakan massa molar. Jika yang diberikan adalah quantity fuel, gunakan hubungan 1 mol = 22,4 liter pada STP (kondisi standar suhu dan tekanan).
3. Gunakan Rasio Mol dari Persamaan Kimia Seimbang
Dari persamaan kimia yang sudah seimbang, gunakan rasio mol untuk menghitung berapa banyak produk yang dihasilkan atau berapa banyak pereaksi yang dibutuhkan.
4. Konversi Kembali ke Gram atau Quantity
Setelah mendapatkan mol, jika diminta dalam gram atau quantity, konversikan kembali ke satuan tersebut menggunakan massa molar atau hubungan fuel pada STP.
Contoh Perhitungan
Contoh soal: Berapa gram karbon dioksida (CO₂) yang dihasilkan jika 10 gram metana (CH₄) dibakar sempurna?
Langkah 1: Tulis persamaan kimia setara:
CH4+2O2→BERSAMA2+2 jam2HAI
Langkah 2: Hitung mol CH₄. Massa molar CH₄ = 16 g/mol.
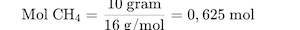
Langkah 3: Gunakan rasio mol.
Dari persamaan, 1 mol CH₄ menghasilkan 1 mol CO₂. Jadi, 0,625 mol CH₄ menghasilkan 0,625 mol CO₂.
Langkah 4: Hitung massa CO₂. Massa molar CO₂ = 44 g/mol.
Massa CO2=0,625 mol×44 g/mol=27,5 gram
Jadi, 10 gram metana akan menghasilkan 27,5 gram karbon dioksida.
Stoikiometri adalah keterampilan penting dalam kimia yang memungkinkan kita menghitung hubungan kuantitatif antara zat-zat dalam reaksi kimia.
Dengan mengikuti langkah-langkah sistematis, kita dapat menentukan jumlah pereaksi dan produk yang terlibat dalam reaksi.
Untuk siswa SMAmemahami stoikiometri adalah dasar yang penting untuk memahami topik-topik kimia yang lebih kompleks seperti termokimia, larutan, dan fuel.
Pointers Belajar Stoikiometri untuk Siswa
- Selalu pastikan persamaan kimia yang digunakan sudah seimbang sebelum melakukan perhitungan.
- Pahami konsep mol dengan baik, karena ini adalah dasar dari kebanyakan perhitungan kimia.
- Latihan secara konsisten dengan berbagai soal untuk meningkatkan keterampilan dalam menghitung stoikiometri.
Dengan menguasai stoikiometri, siswa akan lebih siap menghadapi tantangan soal kimia, baik dalam ujian maupun eksperimen laboratorium. (Z-10)
Sumber:
-
Petrucci, RH, Herring, FG, Madura, JD, & Bissonnette, C. (2011). Kimia Umum: Prinsip dan Penerapan Trendy. Edisi ke-10. Pendidikan Pearson.
-
Chang, R., & Goldsby, Okay. (2016). Kimia. Edisi ke-12. Pendidikan McGraw-Hill.
-
Silberberg, MS (2013). Prinsip Kimia Umum. Edisi ke-3. Pendidikan McGraw-Hill.
-
Brown, TL, LeMay, HE, Bursten, BE, Murphy, C., & Woodward, P. (2014). Kimia: Ilmu Pusat. Edisi ke-13. Pearson.

